ウイルスが細胞に棲みつくための特殊なオルガネラ
複製オルガネラとは
このような病原体によって形成されるオルガネラの存在はかなり古くから知られておりますが、これまでの解析の殆どは透過型電子顕微鏡による形態観察によるもので、病原体オルガネラの形成と維持の分子機構は多くの点は謎に包まれたままでした。しかしながら、近年、電子線トモグラフィーやプロテオーム解析などの解析技術の発達により複製オルガネラの詳細な構造と、形成・維持に関わる細胞側因子群が明らかになりつつあります。私たちは、現在、デングウイルス、日本脳炎ウイルスやC型肝炎ウイルス(HCV)に代表されるフラビウイルスを材料に用い、ウイルスがどのように細胞内に棲みつくのか、ウイルス複製オルガネラ形成という視点に立ち、その分子機構を明らかにしようと試みています。
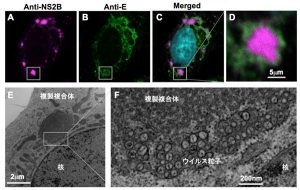
複製オルガネラのプロテオーム解析
フラビウイルスが感染した細胞内には、核近傍の小胞体(ER: endoplasmic reticulum)付近に、ときには直径10μmにも及ぶ巨大なウイルス抗原陽性の構造物が出現します。この構造物は種々の小胞体マーカーに対して陽性を示すことから、小胞体膜の一部が変形して出現したものであると考えられます。私たちはこれまでに、ウイルス複製オルガネラの精製とプロテオーム解析による、複製オルガネラ形成に必要な宿主因子の同定を試みてきました。その中には、小胞体の膜を変形させる機能を持つ蛋白質群や、宿主細胞のストレス応答に関与する因子群などが含まれていました。現在は、これら因子群がどのようにウイルス増殖に関与するのか、その分子機構の解明に挑んでいます。
多くの細胞内病原体は自身の複製に有利になるように、さまざまな細胞機能を巧みに利用します。複製オルガネラは極めて複雑な膜構造を有しており、どのような因子がその形成に関与しているのかまだ多くの不明な点が残されています。今後、このような病原体研究から予想もしない、細胞機能の根幹に関わる重要な分子機構が明らかになることが予想されます。
細胞外微粒子の形成
細胞は直径数百nmの膜で包まれた小胞を放出し、細胞の外には様々な種類の小胞に溢れています。その“微粒子”の中には、産生する細胞由来の蛋白質や核酸などの因子が含まれており、別の細胞に情報を伝達するメッセンジャーとしての役割があります。古くから解析されている微粒子の代表例はウイルスです。ウイルスは、微粒子(=ウイルス粒子)の過剰な産生により生物個体に障害を引き起こす病原体として知られています。一方、最近、ウイルスとは異なる、“エクソソーム”と呼ばれる小胞微粒子が多数存在することが見つかり、生体機能における重要性が明らかになってきました。私たちは、生体膜に包まれたエンベロープウイルスやエクソソームがどのように作られるのか、また、エクソソームの種類とその役割について明らかにしようと研究を進めています。
ウイルス粒子の形成
ウイルスは感染細胞内で複製したあと、別の細胞、あるいは別の個体に伝播します。そのためにウイルスは細胞内から一旦細胞外に出なければなりません。このときにウイルスは宿主細胞に備わっているシステムを巧妙に利用していることが明らかになっています。
細胞外で検出されるウイルス遺伝子は‘キャプシド’と呼ばれるウイルス由来の蛋白質と複合体を形成しています。また、キャプシドはその外側を‘エンベロープ’とよばれる外被膜によって囲まれている場合があります。エンベロープは、様々な環境からウイルス遺伝子を保護するとともに、膜融合を介して効率よく標的細胞に遺伝子を注入するために重要な役割を担っていると考えられます。
レトロウイルスは主にgag、pol、envの三つの遺伝子で構成されています。そのうちのgag遺伝子がコードするGag蛋白質には、ウイルス遺伝子に結合してゲノムRNAを粒子に取り込む役割と、それ自身が規則的に集合(アセンブリ)し多量体を形成して、ウイルス遺伝子を取り囲むキャプシドとしての役割があります。Gag蛋白質を単独で細胞内に発現させると、実際にウイルスが感染した時にみられるのと似たようなウイルス粒子様構造が確認され、その粒子はエンベロープを被り細胞外に出芽、放出されます。これは、Gag蛋白質がウイルスの出芽に必要且つ十分な因子であることを示しています。
1991年、Heinrich Gottlingerらは、gag遺伝子に人為的に変異を導入することにより、Gag蛋白質上にウイルス様粒子の細胞外への放出に必要なアミノ酸配列があることを見つけました。彼らはGag蛋白質のカルボキシル末端に存在するPTAP(Proline-Threonine-Alanine-Proline)という4つのアミノ酸のどれか一つを別のアミノ酸に置換すると、ウイルス粒子形成が出芽の段階で停止してしまうことを見いだしました。PTAP変異型Gagは正常に細胞内でアセンブリするものの、粒子の放出は出芽の最後の段階、すなわち粒子が細胞膜から切り離される直前で停止してしまうことから、このような出芽の最終段階に必要なウイルス側のアミノ酸配列はレイトドメイン(late domain)と呼ばれています。
レイトドメインの発見から約10年後に、この分野における大きな進展がありました。それは、レイトドメインに結合する宿主因子の発見に始まります。2001年、PTAPレイトドメインに結合する細胞側蛋白質因子‘TSG101’が発見され、その2年後の2003年、別のレイトドメインYPXL配列に結合する蛋白質因子‘ALIX’が発見されました。これらの因子群は、もともと細胞の膜蛋白質輸送に関与する因子群として知られており、この結合の発見は、ウイルスの出芽のメカニズムを理解するうえで大きなブレイクスルーとなりました。
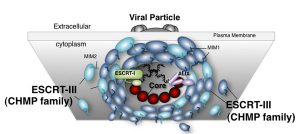
図:ESCRTを介したエンベロープウイルス粒子形成のモデルESCRT-IIIフィラメントが膜狭窄部位周辺にリング状に集積し、蛋白質構造変化とESCRT-IIIの再編成が起こり、膜切り離しが誘導されると考えられている。
ESCRT複合体とは
TSG101とALIXは、Gagのレイトドメイン結合因子として発見される以前に、酵母の解析によりMVB(multivesicular bodies)形成に必要な因子であることが知られていました。この2つの蛋白質は、酵母からヒトに至る真核生物でよく保存されている遺伝子にコードされており、ヒトTSG101、ヒトALIXの酵母のホモログはそれぞれVps23とBro1と呼ばれています。vps23及びbro1遺伝子は、もともとクラスE-VPSと呼ばれる表現型を示す遺伝子群として同定されていました。VPS(Vacuolar Protein Sorting: 液胞選別経路)遺伝子群は、液胞(ヒトのリソソームに相当)への蛋白質輸送経路に障害がある突然変異体から同定された遺伝子群を示します。酵母液胞内で働く蛋白質分解酵素:CPY(カルボキシペプチダーゼY)は、ER(小胞体:Endoplasmic Reticulum)で合成された後、ゴルジ体へ運ばれ、トランスゴルジネットワークにて糖鎖修飾を受けた後、マンノース6リン酸受容体によって認識され、エンドソームを介して液胞へと輸送されます。VPS遺伝子群とは、その変異によって、本来、液胞へ輸送されるべきCPYが誤って細胞表面へと運ばれ、細胞外で検出される表現型を示します。後にこのような表現型を示す変異体の原因遺伝子群はVPS遺伝子と名付けられ、現在、出芽酵母では60種類を超える遺伝子が同定されています。VPS遺伝子群は、主に変異体のリソソームの形状により、クラスAからEの5つのサブグループに分類されており、その中でも液胞膜の横に大きなCPY陽性の新規コンパートメントを形成する変異体はクラスE変異体と呼ばれ、これら変異遺伝子の産物が、MVB小胞形成に直接関わっていると考えられています。
2001年、Scott EmrらによってクラスE-VPS因子群の詳細な機能が解明されました。彼らは、この因子群の中の幾つかは複合体を形成し、‘ユビキチン’と呼ばれる蛋白質分解シグナルに直接結合し、エンドソーム上に運ばれた膜蛋白質を選別する働きがあることを明らかにしました。また、クラスE-VPS には、膜蛋白質をMVB内に送り込むためにエンドソーム膜を内側へと出芽させる働きもあることを報告しました。これらのクラスE-VPS因子複合体群は、その機能に因みESCRT (Endosomal Sorting Complex Required for Transport)と呼ばれています。
MVB/後期エンドソーム形成のメカニズム
正常細胞内では、種々の細胞内小器官(オルガネラ)で蛋白質や脂質の受け渡しが行われています。この受け渡しは、脂質二重層の膜で包まれた‘小胞’が細胞内を能動的に移動することにより行われており、まさに人間社会における交通のような複雑な物流ネットワークが構築されていることから、‘細胞内メンブレントラフィック(intracellular membrane traffic)’と呼ばれています。
細胞表面の増殖因子受容体やイオンチャンネルなどは恒常的に細胞表面に存在しているわけではありません。必要に応じてエンドサイトーシスと呼ばれる経路によって細胞内に取り込まれ、メンブレントラフィックを介してエンドソームに到達した後、様々な選別を受けていることが知られています。たとえば、鉄イオンを細胞内に取り込むトランスフェリン受容体、脂質を取り込むLDL受容体は、細胞内で捕捉したリガンドを放出したあと、リサイクリングエンドソームによって再び細胞表面へと輸送されます。一方、細胞内にシグナルを伝える増殖因子受容体は、恒常的なシグナル伝達を抑えるために、一定期間細胞表面で機能した後、細胞内消化の場であるリソソームへと輸送され分解される運命をたどります。
このリソソームへの膜蛋白質の輸送の過程で、標的膜蛋白質は膜と共にエンドソーム内側へと貫入・出芽し内腔小胞として分離されなければなりません。このようなリソソームへの蛋白質輸送の過程でみられる内腔小胞を含有するエンドソームをMVB (multivesicular bodies:多胞体)・後期エンドソームと呼びます。MVB小胞形成を介した膜蛋白質輸送システムは、膜受容体分子の分解過程だけでなく、リソソームで作用する加水分解酵素の輸送・活性化にも用いられていいます。この加水分解酵素の前駆体は、ゴルジ輸送経路で糖鎖就職を受けた後、エンドソームに蓄積され選別を受け、増殖因子受容体と同様にMVB小胞形成よって膜から分離され、リソソーム内でブロセッシングされることにより成熟し活性化されることが知られています。
ウイルスは宿主細胞のMVB小胞形成過程を乗っ取る
ウイルスは出芽に際して、レイトドメインを介して宿主細胞のESCRT因子群をリクルートします。すなわち、ウイルスは細胞側のMVBでの内腔小胞形成過程を利用することでエンベロープを獲得しているといえるわけです。MVB小胞形成もウイルスの出芽も、細胞の内側から外側へと膜が湾曲し出芽するプロセスを必要とするため、同じシステムによって制御されていても不思議ではありません。
現在、ESCRT因子群がどのように膜を細胞の内側から押し上げ、それによって生じる膜のくびれを切り離しているのか、その詳細な分子メカニズムが明らかになりつつあります。そのモデルの一つは、ESCRT-IIIと呼ばれる因子群がフィラメント状にアセンブリし、膜切り離しの穴を中心に円形ドームを形成し、タンパク質自身の構造変化に伴ってフィラメントの集合様式が変形させ、最終的に膜構造を変化させて切り離すというものです。現在、多くの研究者によってこのモデルを裏付けるための証拠が集められています。
レトロウイルスを用いた解析により、ウイルスの出芽へのESCRT経路の関与が示された後、これはレトロウイルスだけでなく、他のエンベロープウイルスに共通したメカニズムであることが明らかになってきました。PTAP、YPXL、PPXYの三つのレイトドメインは、レトロウイルスだけでなく、フィロウイルス、ラブドウイルスやアレナウイルスなど多くのエンベロープウイルスに保存されており、レイトドメインへの変異の導入やESCRT経路そのものを欠損させることでウイルスの出芽が著しく阻害されることが報告されています。このように、ESCRT経路は、効率よくウイルス遺伝子/キャプシド複合体を細胞外へと放出するための手段として、広く利用されていることがわかってきました。現在、ESCRTとウイルス蛋白質との結合を標的にする薬剤は、種々のウイルス感染症に効果的であることが期待され、その開発が進められています。
ERCRT経路は様々なプロセスに関与する
私たちはこれまでに、ESCRTの本来の機能は、MVB小胞形成とは全く異なったものに由来するのではないかということを提唱してきました。
真核細胞の細胞分裂では、染色体を分配する有糸分裂の後、アクチン/ミオシンからなる収縮環が分裂溝を形成し細胞質が分断される‘細胞質分裂 (cytokinesis) ’が起ります。細胞質分裂の最終過程では、2つの娘細胞を繋ぐ‘ミッドボディー(midbody)’と呼ばれる微小管の束から成る架橋構造が形成されます。最終的に、ミッドボディーの中心部分の生体膜が2つに切り離されて、各々の娘細胞に解離します。
興味深いことに、この過程で重要な働きを持つCEP55という因子にもTSG101とALIXが直接結合することが示されました。CEP55に結合できないTSG101やALIXを発現させると、細胞質分裂が正常に作動しないため、ESCRTはCEP55との結合を介してミッドボディーでの膜の切り離しに関与していると考えられます。つまり、MVB小胞形成とウイルス粒子形成の膜切り離しの機構は、ミッドボディーでの膜切り離しのような同じ膜動態トポロジーを示す現象に、広く利用されているといえます。
エクソソームとは
生物は細胞内だけでなく細胞外にも直径50-100nmの小さな生体膜で囲まれた小胞を多数もっています。この小胞は‘エクソソーム’と呼ばれています。エクソソームには、MHC classII抗原やCD63、CD81など、MVBに特異的に検出される膜蛋白質が多く含まれているため、その起源はMVB内腔に蓄積した小胞であると考えられています。すなわち、細胞内には、MVBとリソソームの融合による蛋白質分解機構とは別に、MVBと細胞表面膜が融合し、内腔小胞をエクソソームとして細胞外へ放出させる機構が存在することを意味しています。エクソソームは、主に免疫系反応など、細胞間コミュニケーションに密接に関わっていることがわかっていますが、最近、microRNAなど、核酸成分の細胞間伝播にも関与していることが明らかになってきました。私たちは今、このエクソソームの形成過程に注目して解析を進めています。現在、内包物の異なる複数のエクソソームが存在すると考えられておりますが、そこには何種類存在し、そしてそれぞれがどのように形成されるのか、またどのような役割を持っているのか、未だに不明な点が多く残されています。私たちは、これまでのウイルス粒子形成の解析のノウハウを生かして、これらの疑問に答えるべく研究を進めています。さらに、人工エクソソームを作成し、任意の内包物を取り込ませた、ナノカプセルの開発にも取り組んでいます。これらの研究は、将来的に新たなDDSドラッグデリバリーシステムの開発にも繋がると期待されます。
パルボウイルスを用いた人工細胞外微粒子の作成
新たな人工細胞外微粒子の作成に関連して、私たちはウイルスキャプシドのin vitro (試験管内での)アセンブリの研究も行っております。パルボウイルスはヒトに感染しうる最も小型のDNAウイルスで、熱やアルコールに耐性を持ち、数ヶ月に渡り安定に粒子構造を形成し続けることが知られています。この最も安定な微粒子を、人工的に作り出す手段について研究を行っています。
さらに、我々は、まだ培養系が確立されていない、ヒトパルボウイルスB19増殖系の確立にも挑んでいます。小児に好発する伝染性紅斑の原因ウイルスであるヒトパルボウイルスB19は、赤芽球系細胞へ感染し、再生不良性貧血や非免疫性胎児水腫の原因であり、妊婦が感染すると高率で流産を引き起こすことが知られています。しかし、B19ウイルスに対するin vitroでの効果的な感染系/増殖系が存在しないために、これら疾患の発症病理機構の解析は進んでいません。このような中、これまでに私たちはB19ウイルスに高感受性赤芽球細胞株 (UT7/Epo-S1)を樹立し、B19ウイルス感染による赤芽球系細胞の細胞傷害機構ならびに細胞周期停止機構を明らかにしてきました。今後、新たなin vitroウイルス増殖系の確立を目指すとともに、UT7/Epo-S1系を用いて、なぜB19ウイルスは赤芽球系細胞にしか感染しないのか、あるいは、なぜ培養細胞では増殖させることができないのか、その秘密を明らかにしていきたいと思っています。
タバコを用いたウイルス粒子の作成
近年、予防ワクチンをはじめとする種々の医療用タンパク質の産生系として、安全性と生産コストの両面から、植物体での発現系が注目されています。私たちは、タバコを用いたヒトパルボウイルスB19のキャプシド蛋白質発現系を構築し、新たな検査方法の確立や、将来のワクチン開発に向けた技術の開発を行っています。
感染とオートファジー
細菌やウイルスなどの多くの病原体は、宿主細胞に侵入し増殖可能な細胞内生態的適所を見つけ出し、伝播のために感染細胞から脱出するしくみを発達させてきました。細胞内の環境は、感染した病原体にとって生態的適所であり、病原体が宿主の獲得免疫系に捕捉されにくくなるだけでなく、豊かな栄養源が豊富に存在するという利点があります。一方、細胞はただ手を拱いて病原体の侵入を許すだけでなく、自然免疫という病原体に対抗する手段を発達させてきました。オートファジー経路はもともと、飢餓時に誘導される栄養源確保の機構として解析されてきましたが、これまでのオートファジーを司る遺伝子:ATG欠損マウスの解析から、細胞内不要物を取り除く浄化機構としての役割が新たに解明されました。そして、このオートファジーこそが、細胞内病原体排除に作用する新たな生体防御機構としての役割を持つことが明らかになりつつあります。このような細胞内病原体に対するオートファジーは自食作用とは異なるのでゼノファジー Xenophagyと呼ばれることもあります。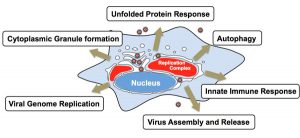
選択的オートファジーはどのように標的を識別するのか
細胞内に侵入した病原体に対するオートファジーには標的を識別する機構があります。これまでの解析によって、この認識機構は、標的物のユビキチンとオートファゴソーム上のATG因子:LC3に結合するアダプター分子よって説明されています。アダプター分子群は自身がもつLIR (LC3 Interacting Region: W/Y/FxxL/I/V consensus)配列を介してLC3と結合し、標的ユビキチンとLC3を橋渡しする因子群として、現在までにp62など複数同定されています。近年、損傷ミトコンドリアを選択的に分解するオートファジー(マイトファジー)に関与しているアダプター因子は、これまで言われていたp62ではなくNDP-52とOPTNの2種類が相補的に機能していることが報告され(Lazarou M 2015 Nature)、選択的オートファジーは複数のアダプターによって制御されていることが明らかになりました。また最近、小胞体を分解するオートファジーに作用する新たなアダプター因子としてFAM134が同定され(Khaminets A 2015 Nature, Mochida K 2015 Nature)、標的に特異的に作用するアダプター分子の全体像が徐々に明らかになりつつあります。
新たなオートファジーアダプター分子の検索
私たちはこれまでに、オートファジー機構の膜動態に関与するATG因子群の系統的な相互作用ネットワークの解析を行い、オートファゴソーム形成に必須なATG複合体間の新規相互作用を明らかにしてきました (Fujita, Morita 2013. J Cell Biol, Suzuki 2014 Structure)。その中で、ATG13という分子がLC3に直接結合することを見出し、また、この結合はATG13上に見つかったLIR を介していることを明らかにしてきました。さらに、ATG13LIRとLC3の共結晶構造解析によって、LIR存在下でのLC3上のK49の側鎖構造変化を見出し、K49はLIRへの結合を調節するゲートキーパーとしての役割があることを証明してきました (Suzuki 2014 Structure)。
最近、私たちは、LC3AのK49をアラニンに置換したLIR高親和性変異体LC3A-K49Aと、K51をアラニンに置換したLIR低親和性変異体LC3A-K51Aの二つの変異体を用い、高親和性変異体により強く結合するLC3結合因子群を、比較定量プロテオーム解析によって網羅的に同定することに成功しました。この解析によって、p62よりも高いスコアにて、高親和性LC3変異体に強く結合し、且つ、ユビキチンに結合する性質を持つ新規LIR因子群(LIRP1-5)見出しています。
私たちは、これらの候補因子群の性状解析を中心に、新たなアダプター分子の同定と、病原体に対する選択的オートファジーの標的認識の分子機構の全体像を明らかにすることを目的として研究を進めています。また、アダプター分子とLC3以外のATG蛋白質群との相互作用を解析し、オートファジーを介した細胞内病原体排除機構の全体像の解明を目指しています。